發布時間:2024-05-21 發布作者:上海通蔚生物
準確的蛋白質定量是大多數蛋白質研究中的關鍵步驟。研究生物分子之間的相互作用對于理解它們的功能非常重要。研究蛋白質與其他分子間的相互作用是理解其功能的關鍵,并且在許多其他領域具有應用,包括在藥物發現、開發等領域有著廣泛應用。
本文的目的主要是介紹如何正確測定蛋白質濃度的關鍵方法和注意事項。蛋白質濃度測定是蛋白質研究的基礎,對其準確性要求很高,并詳細介紹了不同測定方法的優缺點和注意事項。本文將重點介紹不同測定方法的優缺點,幫助您選擇最適合其研究的方案。
6.蛋白質定量的應用
蛋白質濃度定義為樣品中特定蛋白質或一系列不同蛋白質的總量或含量。

蛋白質濃度測定在蛋白質生物學和分子生物學中是必要且廣泛應用的。蛋白質定量分析涉及生產和科研的多個領域和行業,是生物學、食品檢驗摻假、臨床檢驗、疾病診斷、質量檢驗等領域最常用的方法。在分離、純化和分析之前必須計算蛋白質樣品的濃度。
蛋白質定量對于更好地了解樣品或配方產品中的總蛋白質含量是必不可少的。這是涉及蛋白質提取或分析的任何實驗工作流程中的重要程序。精確的蛋白質濃度是為后續實驗生成可靠數據的關鍵。
蛋白質的定量方法有很多種,其中常見的有凱氏法、雙縮脲法、Lowry法、BCA法、Bradford法、紫外光吸收法(280nm)等六種。
蛋白質濃度的測量主要基于兩個原則:一是利用蛋白質的共同特征,如氮、肽鍵、折射率等,二是利用特定的氨基酸殘基,堿性或酸性蛋白質中的基團和芳香族基團可測定蛋白質含量。
凱氏定氮法由JohannKjeldahl于1883年發明。它包括消化、蒸餾和滴定三個步驟。在該方法中,用濃酸和催化劑消化蛋白質后,總有機氮轉化為硫酸銨。添加NaOH來中和沼渣并將銨轉化為氨。蒸餾出氨并收集在過量硼酸的接收瓶中以形成硼酸銨。通過使用合適的滴定技術滴定殘留的硼酸來測量樣品的總氮含量。需要使用轉換因子(F)將測得的氮濃度轉換為蛋白質含量。
比色測定方法基于響應蛋白質而在可見光譜中產生有色溶液。顏色變化與蛋白質濃度成正比,并通過特定波長下的吸光度測定來測量。通常,使用牛血清白蛋白(BSA)標準溶液繪制的標準曲線來測定蛋白質含量。比色測定包括縮二脲試驗、Lowry測定、二辛可寧酸(BCA)測定和考馬斯藍G-250染料結合(Bradford)測定。
雙縮脲試驗,也稱為Piotrowski試驗,是一種測定樣品中總蛋白質的化學方法。由于蛋白質分子中肽鍵(-CONH-)的結構與縮二脲相似,因此蛋白質在堿性溶液中也能與銅離子(Cu2+)反應生成紫紅色化合物。
在縮二脲法中,Cu2+被蛋白質內的兩個肽鍵還原,然后螯合成紫色絡合物。產品的顏色強度與蛋白質濃度成正比,并通過540nm處的吸收光譜進行測量。
后來,縮二脲試驗經過改進,進而發展為肽的兩種比色分析:Lowry測定法和BCA測定法。
Lowry測定法由OliverLowry于1951年首次提出[1]。在Lowry法中,肽鍵首先在堿性條件下將銅離子還原成亞銅離子。Folin-Ciocalteu試劑隨后與亞銅離子以及酪氨酸、色氨酸和半胱氨酸的側鏈反應,產生一種深藍色復合物,稱為雜多鉬藍。雜多鉬藍的顏色強度與樣品中的蛋白質含量呈正相關,通過660nm處的吸光度進行測量。
BCA測定是在Lowry測定的基礎上改進的。在BCA測定中,蛋白質肽鍵螯合Cu2+離子,并在堿性條件下將其還原為亞銅離子(Cu+)[2]。Cu+離子與BCA反應形成紫色絡合物,其顏色強度通過562nm處的吸光度測定來測量[2][3]。吸光度與蛋白質濃度在很寬的范圍內具有良好的線性關系。

Bradford測定法最初由MarionM.Bradford于1976年開發[4],是一種染料結合方法,基于考馬斯亮藍G-250染料-蛋白質相互作用引起的顏色變化。考馬斯G-250染料與蛋白質上的可電離基團發生反應,導致蛋白質構象發生變化并隨后暴露疏水袋[4][5]。該染料與疏水性氨基酸結合,形成穩定的藍色復合物。藍色復合物的顏色強度可以通過595nm處的吸光光度測定法進行測量。吸光度與蛋白質濃度呈線性關系。
這是一種通過測量樣品在280nm處的紫外吸光度(A280)來直接測定蛋白質濃度的方法。蛋白質中的酪氨酸、色氨酸等芳香族氨基酸能吸收紫外光[6],這些芳香族氨基酸的吸收峰在280nm波長處,且吸收峰的光密度與它們的濃度成正比,因此可以作為蛋白質定量測定的依據。由于各種蛋白質中酪氨酸和色氨酸的含量不同,需要知道它們的消光系數(ε),作為準確定量的參考。ε系數可以通過實驗測定,也可以根據氨基酸序列計算得出。
在ELISA中,目標蛋白被酶標記的特異性抗體捕獲,然后通過與其底物的酶反應進行定量。通過酶標儀在特定波長下測量所產生的復合物的光吸收。酶-底物反應產生的顏色強度與樣品中的蛋白質濃度成正比。參照標準曲線計算蛋白質濃度。現在市場上有各種優質的定量ELISA試劑盒,為特定蛋白的定量提供了更多的便利。
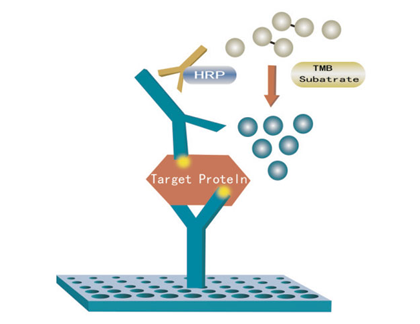
基于上述蛋白定量原理,各種蛋白檢測試劑盒也逐漸面世,主要包括BCA蛋白檢測試劑盒和Lowry蛋白檢測試劑盒,實現了蛋白濃度測定的簡單、高穩定性、高靈敏度和高兼容性。
當測定樣品中的蛋白質含量時,首先要考慮的是選擇合適的測量方法。由于可用的蛋白質檢測方法多種多樣,因此我們需要考慮許多因素,以確保所使用的檢測方法最適合應用。每種測定都有其自身的優點和局限性。由于沒有一種試劑可以被認為是理想或最佳的蛋白質測定方法,因此還可能需要獲得一種以上類型的蛋白質測定用于研究應用。
沒有單一的測定可以用來量化所有蛋白質類型。因為在選擇與樣品最相容的適當方法之前,需要考慮某些方法的具體限制。為了確保測量數據準確,必須考慮幾個因素。
選擇合適的方法取決于樣品中蛋白質的特性以及分析方法的特征。一般來說,選擇蛋白質濃度測定方法需要考慮許多因素,包括樣品或裂解緩沖液中的干擾劑、測定靈敏度和樣品體積、樣品制備、分析速度、便利性和試劑的可用性、測定時間、蛋白質標準、蛋白質樣品的稀釋度、蛋白質之間的變化、設備要求以及與待分析樣品的緩沖液成分的兼容性。
蛋白質濃度的測量對于蛋白質純化、電泳、細胞生物學、分子生物學和其他研究應用是必要的。
紫外吸收法在蛋白質、酶的生化制備中應用十分廣泛,此方法適合配合色譜柱實時監測蛋白質的吸附或洗脫情況,但結果不太準確。
Bradford方法適用于大規模樣品分析,但樣品中不應含有高濃度的去污劑,這需要更嚴格的樣品標準。建議一般使用,特別是用于評估細胞組分的蛋白質含量和估計凝膠電泳的蛋白質濃度。
Lowry方法用于測量酶分級過程中的蛋白質、混合組織蛋白質、測量極少量的蛋白質或高度稀釋的蛋白質以及分析大量相似的蛋白質樣品。
標準BCA測定可用于確定每個均質樣品的蛋白質濃度。
不同的蛋白質定量方法各有優缺點,沒有一種方法能夠完美適用于所有實驗。選擇合適的測定方法需要根據實驗需求,權衡測定時間、靈敏度、準確度等因素。希望這篇文章能幫助讀者更好地了解各種蛋白質定量方法,并選擇最適合其研究需求的方法。
引用參考:
[1] Lowry OH, Rose Brough NJ, et al. Protein measurement with the folin phenol reagent. J Biol Chem. 1951 Nov;193(1):265-75.
[2] Gornall AG, Bardawill CJ, David MM. Determination of serum proteins by means of the biuret reaction. J Biol Chem. 1949;177:751–766.
[3] Smith PK, Krohn RI, et al. Measurement of protein using bicinchoninic acid. Anal Biochem. 1985;150:76-85.
[4] M M Bradford. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding [J]. Anal Biochem. 1976 May 7; 72:248-54.
[5] Sedmak JJ, Grossberg SE. A rapid, sensitive, and versatile assay for protein using Coomassie brilliant blue G250. Anal Biochem. 1977;79:544–552.
[6] Simonian M. H. Spectrophotometric determination of protein concentration. In: Wrolstad R. E., editor. Handbook of Food Analytical Chemistry. New Jersey, NJ, USA: John Wiley & Sons; 2000. pp. 115 -121.