發布時間:2024-11-21 發布作者:上海通蔚生物
數字PCR(dPCR)是繼終點PCR和實時定量PCR(RT-qPCR)之后的第三代PCR。數字PCR具有高靈敏度、準確性和絕對量化樣本中目標DNA量的能力。這種高靈敏度可以檢測罕見突變、拷貝數變異(CNV)、低豐度轉錄本、罕見microRNA和極低病毒載量。
數字PCR的概念最早由Sykes等人于1992年提出,他們認識到,極限稀釋、終點PCR和泊松統計的組合可以產生核酸濃度的絕對測量值(Sykes等人,1992年)。隨后,約翰霍普金斯大學的Vogelstein和Kinzler開發了一種方法,將樣本稀釋并分配到可以單獨擴增單個模板分子的程度,每個分子都在單獨的分區中,并使用熒光探針檢測產物(Vogelstein和Kinzler,1999年)。“數字PCR”一詞就是為描述這種新方法而創造的。
dPCR與標準終點PCR的不同之處在于,樣本首先被隨機分成20,0000個子反應,而不是在批量樣本上作為單個反應運行。PCR反應在每個分區上進行,可以是單個液滴,也可以是在微流體芯片上。理想情況下,每個分區將包含一個或零個目標序列。為了補償包含多個目標序列的少數分區,數據通過泊松統計處理。如果分區包含可擴增序列,則將其計為陽性(否則將其計為陰性)。
假設每個分區只有一個目標,則可以通過計算陽性數并根據分區數和稀釋因子進行推斷來絕對量化原始樣本中有多少個目標。由于計算了實際目標數,因此不需要校準曲線,但建議對已知樣本和數量進行控制,以幫助驗證數據,尤其是為了發表。
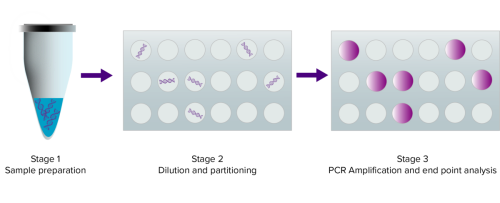
1.樣品制備
與任何基因組分析一樣,良好的樣品制備至關重要。dPCR可用于擴增任何純化的DNA樣品(gDNA或cDNA),但與qPCR一樣,無法直接擴增RNA。因此,在dPCR分析之前,必須分離任何感興趣的mRNA靶標并將其轉化為cDNA。
然后將純化的gDNA或cDNA與正向和反向引物以及水解探針混合,每個引物都設計為具有與目標基因/目標DNA互補的序列。與傳統PCR一樣,引物退火到目標序列的3'和5'端(通常長度為60-150bps)。此外,與傳統PCR不同的是,5'核酸酶(水解)探針隨后在正向和反向引物之間退火,并包括5'熒光團和3'猝滅劑。水解探針增加了反應的靈敏度。與所有PCR和qPCR一樣,引物和探針設計是獲得良好數據的關鍵。
2.稀釋和分配
在樣品制備和添加引物和主混合物后,dPCR檢測將樣品混合物分成單獨的納升反應,因此每個分區中有1個或0個目標DNA分子。一些dPCR平臺將混合物分成單獨的微模塑料孔,而其他dPCR平臺將納升大小的反應液滴創建為油/水乳液。然后,dPCR分析大約20,000個單獨的qPCR反應。
3.PCR擴增和終點分析
分割后,使用常規PCR循環參數擴增反應。隨著DNA聚合酶從正向引物延伸,其核酸外切酶活性會降解探針,從3′猝滅劑中釋放出5′熒光團,進而發出可檢測的熒光。如果檢測包括插入染料而不是水解探針,則熒光會隨著雙鏈PCR擴增子的積累而增加。
PCR循環完成后,任何包含一個模板或目標DNA序列的分區都會發出熒光。帶有熒光的液滴或孔的總數代表樣品中的目標分子總數。實驗完成后,可以通過標準工具分析數據。
ddPCR系統中的樣本分割可實現單個模板分子的靈敏、特異性檢測和精確定量,同時減輕靶標競爭的影響,使PCR擴增對抑制的敏感性降低,并大大提高僅相差一個核苷酸的檢測的鑒別能力。與其他PCR方法相比,數字PCR具有顯著優勢:絕對定量和大大增強的靈敏度和動態范圍。由于其高靈敏度、精確度和絕對定量,數字PCR在許多應用中將核酸分析的范圍擴展到其他方法無法企及的范圍: