發(fā)布時間:2025-02-26 發(fā)布作者:上海通蔚生物
Westernblot,又稱免疫印跡法,是由Towbin等人在1979年發(fā)展完善,并由W.NealBurnette于1981年命名的常用蛋白質分析方法。該技術可用于定性和半定量分析蛋白質。Westernblot主要包括三個步驟:按大小分離蛋白質(通常使用SDS-PAGE),將蛋白質轉移到固體支持物(例如硝酸纖維素膜或PVDF膜)上,以及使用抗體(通常是一抗和二抗)標記目標蛋白質以便進行可視化。需要注意的是,Westernblot的半定量分析需要謹慎操作并使用合適的內參對照。
Westernblot是一種利用抗體特異性檢測蛋白質的技術。首先,蛋白質樣品通過SDS-PAGE按分子量大小分離,然后通過電泳轉移到固相支持物(例如NC膜或PVDF膜)上。膜通過疏水作用和靜電作用吸附蛋白質。為了防止抗體非特異性結合,使用封閉液(例如蛋白質溶液、脫脂牛奶或BSA)封閉膜上未結合蛋白質的位點。接下來,將膜與針對目標蛋白質的一抗孵育,使一抗特異性結合到目標蛋白質上。洗滌去除未結合的一抗后,再用標記的二抗孵育。二抗與一抗結合,并通過其標記物(例如酶或熒光染料)放大信號,從而實現目標蛋白質的可視化和檢測。通過比較條帶的強度,可以對目標蛋白質進行半定量分析。
蛋白質印跡法涉及六個步驟,包括樣品制備、凝膠電泳、蛋白質轉移、阻斷、抗體孵育以及蛋白質檢測和可視化。
1.樣品制備
蛋白質可以從不同的樣品中提取,例如組織或細胞。由于組織樣品的結構程度較高,因此首先通過機械裝置(例如均質機或超聲處理)分解組織。通常使用蛋白酶和磷酸酶抑制劑來防止樣品在低溫下消化。蛋白質提取后,檢測蛋白質的濃度很重要,這允許測定每個孔中裝入的蛋白質的質量。分光光度計通常用于蛋白質濃縮。
2.凝膠電泳
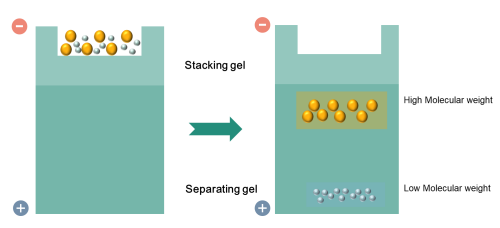
最常用的凝膠是聚丙烯酰胺凝膠(PAG)和裝有十二烷基硫酸鈉(SDS)的緩沖液。Westernblot使用兩種類型的瓊脂糖凝膠:濃縮凝膠用于將所有蛋白質濃縮在一個帶中,分離凝膠可根據蛋白質的分子量進行分離。在SDS-PAGE中,施加電壓時,較小的蛋白質遷移得更快。PAGE可以根據由不同濃度的PAG控制的均勻孔徑分離從5到2,000kDa的蛋白質。通常分離凝膠的濃度為5%、8%、10%、12%或15%。當我們選擇適當百分比的分離凝膠時,我們應該考慮目標蛋白質的大小。已知的蛋白質重量越小,就應該使用更高百分比的凝膠。
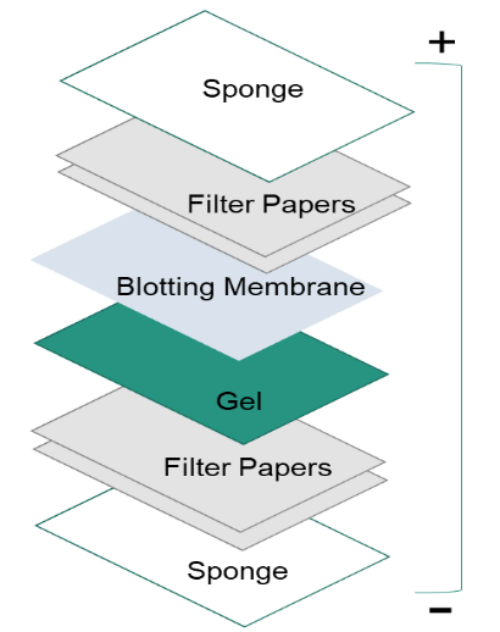
3.蛋白質轉移
通過凝膠電泳分離蛋白質后,蛋白質從凝膠內部轉移到固體支持膜上,使蛋白質可被抗體檢測到。轉移蛋白質的主要方法稱為電印跡,它使用垂直于凝膠表面的電場將蛋白質從凝膠中拉出并移入膜中。它可以在半干或濕條件下進行,而濕條件通常更可靠,因為它不太可能使凝膠變干。如左圖所示,膜位于凝膠表面和過濾器之間。轉移夾層如下形成:纖維墊(海綿)、濾紙、凝膠、膜、濾紙、纖維墊(海綿)。
4.封閉
封閉是Westernblot中的一個重要步驟,可以防止抗體非特異性地結合到膜上。最常用的典型封閉劑是BSA和脫脂奶粉。當膜放入蛋白質的稀溶液中時,蛋白質會附著在膜上所有目標蛋白質尚未附著的地方。這樣可以減少Westernblot最終產物中的“噪音”,從而得到更清晰的結果。
5.抗體孵育
阻斷后,將一抗與膜孵育,一抗即可與目標蛋白結合。一抗的選擇取決于要檢測的抗原。用抗體緩沖液沖洗膜有助于減少背景并去除未結合的抗體。沖洗膜后,將膜暴露于特異性酶標記的二抗中。進行二抗孵育時,標記的二抗可以與已與目標蛋白反應的一抗結合。根據一抗的種類,我們可以選擇合適的二抗。
6.蛋白質檢測和可視化
底物與結合到二抗上的酶發(fā)生反應,生成有色物質。它使我們能夠知道目標蛋白質的密度和位置。通過將蛋白質條帶與標記進行比較,可以得到大小近似值。有幾種檢測系統(tǒng)可用于蛋白質可視化,例如比色檢測、化學發(fā)光檢測、放射性檢測和熒光檢測。電化學發(fā)光(ECL)系統(tǒng)是最常見的檢測方法。
Westernblot通常用于定性檢測蛋白質和翻譯后修飾(例如磷酸化)。除此之外,它還可用于醫(yī)學診斷,例如HIV檢測或BSE檢測。