- 首頁
- 科研產(chǎn)品
ELISA試劑盒
PCR試劑盒
生化試劑盒
細(xì)胞系
細(xì)胞庫
基礎(chǔ)培養(yǎng)基
完全培養(yǎng)基
原代細(xì)胞
細(xì)胞專用培養(yǎng)基
菌株
生化試劑
病理染色液
科研抗體
標(biāo)準(zhǔn)品
血清
- 公司簡介
- 公司新聞
- 技術(shù)服務(wù)
- 代理品牌
- 訂購中心
- 加入通蔚
發(fā)布時間:2024-09-23 發(fā)布作者:上海通蔚生物
ELISA(酶聯(lián)免疫吸附實驗)是一種利用特異性抗體(抗原)反應(yīng)將目標(biāo)抗原(抗體)結(jié)合在固相載體上,并利用酶標(biāo)記的抗體(或抗原)進(jìn)行檢測,并根據(jù)顯色反應(yīng)的強(qiáng)弱來定量樣品中目標(biāo)物質(zhì)的含量。它是一種利用抗原抗體特異性結(jié)合進(jìn)行免疫反應(yīng)的定性和定量檢測方法,目前廣泛應(yīng)用生物學(xué)、醫(yī)學(xué)等多種研究領(lǐng)域。
在ELISA中,將已知的抗原或抗體結(jié)合在固相載體表面,然后利用酶標(biāo)記(偶聯(lián))的抗體或抗原與之孵育,測量加入底物后形成的產(chǎn)物的光吸收并將其轉(zhuǎn)換為數(shù)值來進(jìn)行定性和定量分析。如果對定性和定量分析不是很理解,可以參考這篇文章《ELISA檢測試劑盒:定性與定量分析的優(yōu)勢比較》。根據(jù)抗原抗體結(jié)合,該檢測方法分為直接ELISA、間接ELISA、夾心ELISA法和競爭ELISA法等。
直接ELISA法
原理:將目標(biāo)蛋白(或目標(biāo)抗體)固定在酶標(biāo)板上,與針對該目標(biāo)蛋白的酶標(biāo)記抗體(或針對該目標(biāo)抗體的特異性抗原)一起孵育,洗滌后,測量微孔板孔結(jié)合酶的活性。
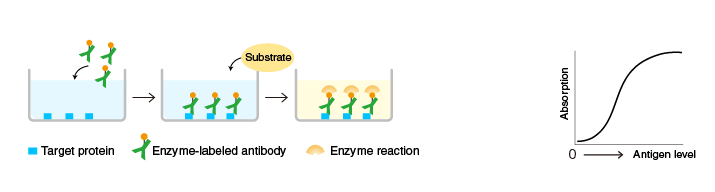
間接ELISA法
原理:將目標(biāo)蛋白(或目標(biāo)抗體)固定在酶標(biāo)板上,隨后分兩步來進(jìn)行檢測,先加入檢測抗體或抗原進(jìn)行特異性結(jié)合。其次再加入酶標(biāo)二抗檢測并利用底物顯色。
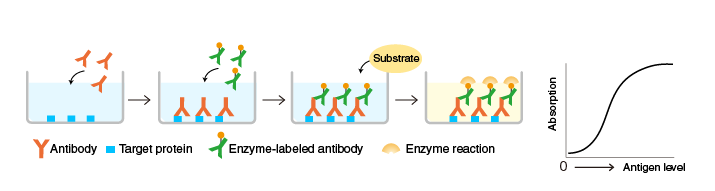
夾心ELISA法
原理:將針對目標(biāo)蛋白的抗體固定在酶標(biāo)板,先與目標(biāo)蛋白孵育,然后與另一種用酶標(biāo)記的目標(biāo)蛋白特異性抗體孵育。清洗后,測量微孔板孔結(jié)合酶的活性。
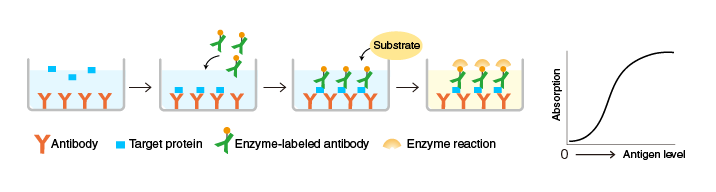
競爭ELISA法
原理:將針對特定目的蛋白的抗體固定在酶標(biāo)板,與含有目的蛋白的樣品以及已知量的酶標(biāo)記的目的蛋白一起孵育,反應(yīng)結(jié)束后,測量微孔板孔結(jié)合酶的活性。
當(dāng)樣品中的抗原水平較高時,抗體結(jié)合的酶標(biāo)抗原水平較低,顏色較淺。相反,當(dāng)抗原水平較低時,抗體結(jié)合的酶標(biāo)抗原水平較高,顏色較深。
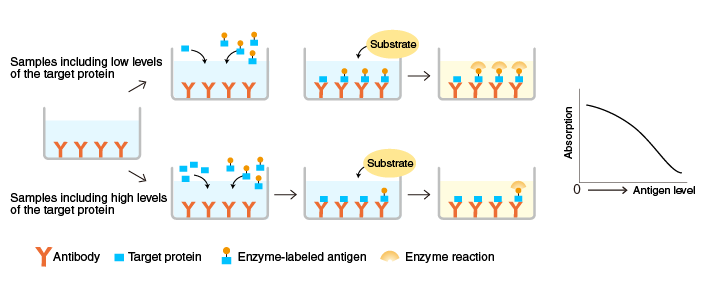
上述是ELISA實驗原理步介紹,上述4種ELISA法檢測原理有區(qū)別,在進(jìn)行ELISA實驗時候,結(jié)合自己檢測目標(biāo)及實驗需求進(jìn)行選擇。如果想了解更多ELISA法區(qū)別,本篇幅有限,可以參考這篇文章《酶聯(lián)免疫試劑盒常見5種實驗檢測方法》。接下來以夾心法為列,詳細(xì)介紹下ELISA實驗步驟。
1、試劑和設(shè)備的準(zhǔn)備
2、抗體的固定化
將稀釋后的抗體加入96孔ELISA板的每個孔中,密封板以防止蒸發(fā),并在4°C下孵育15-18小時以固定抗體。
3、洗滌
除去稀釋的抗體,用洗滌液洗滌3次。
4、封閉
向每個孔中添加封閉緩沖液,并讓其在37°C下孵育1小時,以減少目標(biāo)蛋白與孔的非特異性結(jié)合。
5、洗滌
除去封閉緩沖液,用洗滌液洗滌3次。
6、樣品添加
用樣品稀釋緩沖液稀釋樣品,并將每個樣品100μL添加到每個孔中。為制作校準(zhǔn)曲線,在同一板上準(zhǔn)備標(biāo)準(zhǔn)品的一系列稀釋液。將其在37°C下孵育1小時。
7、洗滌
取出樣品,用洗滌液洗滌5次。
8、檢測抗體的添加
用樣品稀釋緩沖液稀釋檢測抗體,每孔加入100μL,
37°C孵育1小時。
9、洗滌
反應(yīng)結(jié)束后,去除檢測抗體,用洗滌液洗滌5次。
10、酶標(biāo)二抗的添加
用樣品稀釋緩沖液稀釋酶標(biāo)二抗,每孔加入100μL,
37℃孵育1小時。
11、洗滌
反應(yīng)結(jié)束后,除去二抗,用洗滌液洗滌5次。
12、添加底物溶液。
孵育直至顏色顯現(xiàn)。
13、用讀板器測量450nm處的吸收率。
